Интерферон лямбда эффективен против вирусов
Добавил пользователь Владимир З. Обновлено: 19.09.2024
Интерфероны – группа белковых молекул, обладающих широким спектром воздействия на организм. Интерферон лямбда (интерферон III типа) открыт сравнительно недавно – около 20 лет назад – и является относительно малоизученным. Изучение его свойств и механизмов действия вызывает большой интерес, поскольку, обладая сходством с интерферонами I типа, интерферон лямбда имеет ряд отличительных особенностей, которые создают предпосылки для расширения его клинического применения. В частности, интерферон лямбда продуцируется не всеми клетками организма, а значит, имеет более целенаправленное воздействие, чем интерфероны I типа, что снижает системные побочные эффекты. Обзор посвящен биологической активности экзогенного интерферона лямбда, рассматриваются механизмы противовирусной, противоопухолевой, противогрибковой, иммуномодулирующей активности, а также возможности его применения в клинической практике при таких заболеваниях, как синдром Шегрена, атопическая астма, аутоиммунный артрит, различные опухоли, а также в отношении самых разных, как РНК-, так и ДНК-содержащих вирусов, которые атакуют поверхности анатомических барьеров дыхательных путей, желудочно-кишечного тракта, гематоэнцефалического барьера и печени. Также рассматривается пегилированный рекомбинантный интерферон лямбда, для которого начаты клинические исследования, продемонстрировавшие более высокий профиль безопасности пегилированного интерферона лямбда по сравнению с пегилированным интерфероном альфа.
Ключевые слова
Об авторах
Николай Андреевич Кихтенко
630091, г. Новосибирск, Красный просп., 52
Лариса Алексеевна Олейник
630091, г. Новосибирск, Красный просп., 52
Вячеслав Константинович Макаров
630091, г. Новосибирск, Красный просп., 52
Елизавета Петровна Нагорская
630091, г. Новосибирск, Красный просп., 52
Павел Геннадьевич Мадонов, д.м.н.
630091, г. Новосибирск, Красный просп., 52
Список литературы
1. Артамонов А.В., Бекарев А.А., Дыгай А.М., Жданов В.В., Киншт Д.Н., Мадонов П.Г., Шерстобоев Е.Ю. Пегилированный интерферон лямбда, обладающий высокой биодоступностью при пероральном применении, и способ его получения. Пат. РФ 2678332; Опубл. 28.01.2019.
2. Григорян С.С. Интерфероны лямбда (3-й тип интерферонов) и вирусные инфекции. Интерферон-2011: сб. науч. ст. М., 2012. 512 с.
4. Ank N., West H., Bartholdy C., Eriksson K., Thomsen A.R., Paludan S.R. Lambda interferon (IFNlambda), a type III IFN, is induced by viruses and IFNs and displays potent antiviral activity against select virus infections in vivo. J. Virol. 2006; 80 (9): 4501–4509. doi: 10.1128/JVI.80.9.4501-4509.2006
5. Bandi P., Pagliaccetti N.E., Robek M.D. Inhibition of type III interferon activity by orthopoxvirus immunomodulatory proteins. J. Interferon Cytokine Res. 2010; 30 (3): 123–134. doi: 10.1089/jir.2009.0049
6. Baños-Lara Mdel R., Harvey L., Mendoza A., Simms D., Chouljenko V.N., Wakamatsu N., Kousoulas K.G., Guerrero-Plata A. Impact and regulation of lambda interferon response in human metapneumovirus infection. J. Virol. 2015; 89 (1): 730–742. doi: 10.1128/JVI.02897-14
7. Bartlett N.W., Buttigieg K., Kotenko S.V., Smith G.L. Murine interferon lambdas (type III interferons) exhibit potent antiviral activity in vivo in a poxvirus infection model. J. Gen. Virol. 2005; 86 (6): 1589–1596. doi: 10.1099/vir.0.80904-0
8. Blazek K., Eames H.L., Weiss M., Byrne A.J., Perocheau D., Pease J.E., Doyle S., McCann F., Williams R.O., Udalova I.A. IFN-l resolves inflammation via suppression of neutrophil infiltration and IL1b production. J. Exp. Med. 2015; 212: 845–853. doi:10.1084/jem.20140995
9. Caine E.A., Scheaffer S.M., Arora N., Zaitsev K., Artyomov M.N., Coyne C.B., Moley K.H., Diamond M.S. Interferon lambda protects the female reproductive tract against Zika virus infection. Nat. Commun. 2019; 10 (1): 280. doi: 10.1038/s41467-01807993-2
10. Carrick D.M. Interferon lambda: an immune system factor that cancer epidemiologists should consider. J. Interferon. Cytokine Res. 2019; 39 (10). 592–593. doi: 10.1089/jir.2019.0033 [Epub ahead of print]
11. Castillo-Martínez D., Juarez M., Patlán M., Páez A., Massó F., Amezcua-Guerra L.M. Type-III interferons and rheumatoid arthritis: Correlation between interferon lambda 1 (interleukin 29) and antimutated citrullinated vimentin antibody levels. Autoimmunity. 2017; 50 (2): 82–85. doi: 10.1080/08916934.2017.1289181
12. Chan H.L.Y., Ahn S.H., Chang T.T., Peng C.Y., Wong D., Coffin C.S., Lim S.G., Chen P.J., Janssen H.L.A., Marcellin P., Serfaty L., Zeuzem S., Cohen D., Critelli L., Xu D., Wind-Rotolo M., Cooney E.; LIRA-B Study Team. Peginterferon lambda for the treatment of HBeAg-positive chronic hepatitis B: A randomized phase 2b study (LIRA-B). J. Hepatol. 2016; 64 (5): 1011–1019. doi: 10.1016/j.jhep.2015.12.018
13. Cui L., Yu F., Ma J., Pei H., Zuo L. Effects of DENV-2 infection on the expression of IL-29 in primary HUVECs cultured on hydrogel substrates. Chinese Journal of Microbiology and Immunology (China). 2015; 35 (1): 7–13. doi: 10.3760/cma.j.issn.0254-5101.2015.01.002
14. Dantas A.T., Gonçalves S.M., Pereira M.C., de Almeida A.R., Marques C.D., Rego M.J., Pitta Ida R., Duarte A.L., Pitta M.G. Interferons and systemic sclerosis: correlation between interferon gamma and interferon-lambda 1 (IL-29). Autoimmunity. 2015; 48 (7): 429–433. doi: 10.3109/08916934.2015.1054028
15. Davidson S., McCabe T.M., Crotta S., Gad H.H., Hessel E.M., Beinke S., Hartmann R., Wack A. IFNλ is a potent anti-influenza therapeutic without the inflammatory side effects of IFNα treatment. EMBO Mol. Med. 2016; 8 (9): 1099–112. doi: 10.15252/emmm.201606413
16. Douam F., Soto Albrecht Y.E., Hrebikova G., Sadimin E., Davidson C., Kotenko S.V., Ploss A. Type III interferon-mediated signaling is critical for controlling live attenuated yellow fever virus infection in vivo. MBio. 2017; 8 (4): e00819-17. doi: 10.1128/mBio.00819-17
17. Espinosa V., Dutta O., McElrath C., Du P., Chang Y.J., Cicciarelli B., Pitler A., Whitehead I., Obar J.J., Durbin J.E., Kotenko S.V., Rivera A. Type III interferon is a critical regulator of innate antifungal immunity. Sci. Immunol. 2017; 2 (16): eaan5357. doi:10.1126/sciimmunol.aan53
18. Flisiak R., Shiffman M., Arenas J., Cheinquer H., Nikitin I., Dong Y., Rana K., Srinivasan S. A randomized study of peginterferon lambda-1a compared to peginterferon alfa-2a in combination with ribavirin and telaprevir in patients with genotype-1 chronic hepatitis C. PLoS One. 2016; 11 (10): e0164563. doi:10.1371/journal.pone.0164563
19. Ha Y.J., Choi Y.S., Kang E.H., Chung J.H., Cha S., Song Y.W., Lee Y.J. Increased expression of interferon-λ in minor salivary glands of patients with primary Sjögren’s syndrome and its synergic effect with interferon-α on salivary gland epithelial cells. Clin. Exp. Rheumatol. 2018; 36 (Suppl. 112, 3): 31–40.
20. Hausman D.F., Dodds M.G. Use of pegylated type III interferons for the treatment of hepatitis C. Patent WO2009149377A1; Publ. 10.12.2009.
21. Hermant P., Michiels T. Interferon-λ in the context of viral infections: production, response and therapeutic implications. J. Innate Immun. 2014; 6: 563–574. doi: 10.1159/000360084
22. Ilyushina N.A., Lugovtsev V.Y., Samsonova A.P., Sheikh F.G., Bovin N.V., Donnelly R.P. Generation and characterization of interferon-lambda 1-resistant H1N1 influenza A viruses. PLoS One. 2017; 12 (7): e0181999. doi: 10.1371/journal.pone.0181999
23. Jounai K., Sugimura T., Ohshio K., Fujiwara D. Oral administration of Lactococcus lactis subsp. lactis JCM5805 enhances lung immune response resulting in protection from murine parainfluenza virus infection. PLoS One. 2015; 10 (3): e0119055. doi: 10.1371/journal.pone.0119055
25. Kim S., Kim M.J., Kim C.H., Kang J.W., Shin H.K., Kim D.Y., Won T.B., Han D.H., Rhee C.S., Yoon J.H., Kim H.J. The superiority of IFN-λ as a therapeutic candidate to control acute influenza viral lung infection. Am. J. Respir. Cell. Mol. Biol. 2017; 56 (2): 202–212. doi: 10.1165/rcmb.2016-0174OC
26. Klinkhammer J., Schnepf D., Ye L., Schwaderlapp M., Gad H.H., Hartmann R., Garcin D., Mahlakõiv T., Staeheli P. IFN-λ prevents influenza virus spread from the upper airways to the lungs and limits virus transmission. Elife. 2018; 7: e33354. doi: 10.7554/eLife.33354
27. Koch S., Finotto S. Role of interferon-l in allergic asthma. J. Innate Immun. 2015; 7: 224–230. doi: 10.1159/000369459
28. Kotenko S.V., Gallagher G., Baurin V.V., LewisAntes A., Shen M., Shah N.K., Langer J.A., Sheikh F., Dickensheets H., Donnelly R.P. IFN-lambdas mediate antiviral protection through a distinct class II cytokine receptor complex. Nat. Immunol. 2003; 4 (1): 69–77. doi: 10.1038/ni875
29. Lasfar A., Zloza A., Silk A.W., Lee L.Y., Cohen-Solal K.A. Interferon lambda: toward a dual role in cancer. J. Interferon Cytokine Res. 2019; 39 (1): 22–29. doi: 10.1089/jir.2018.0046
30. Lazear H.M., Nice T.J., Diamond M.S. Interferon-λ: immune functions at barrier surfaces and beyond. Immunity. 2015; 43 (1): 15–28. doi: 10.1016/j.immuni.2015.07.001
31. Lazear H.M., Daniels B.P., Pinto A.K., Huang A.C., Vick S.C., Doyle S.E., Gale M.Jr., Klein R.S., Diamond M.S. Interferon-λ restricts West Nile virus neuroinvasion by tightening the bloodbrain barrier. Sci. Transl. Med. 2015; 7: 284ra59. doi: 10.1126/scitranslmed.aaa4304
32. Lazear H.M., Schoggins J.W., Diamond M.S. Shared and distinct functions of type I and type III interferons. Immunity. 2019; 50 (4): 907–923. doi:10.1016/j.immuni.2019.03.025
33. Lee S., Baldridge M.T. Interferon-lambda: a potent regulator of intestinal viral infections. Front. Immunol. 2017; 8: 749. doi: 10.3389/fimmu.2017.00749
34. Lee S.J., Lee E.J., Kim S.K., Jeong P., Cho Y.H., Yun S.J., Kim S., Kim G.Y., Choi Y.H., Cha E.J., Kim W.J., Moon S.K. Identification of pro-inflammatory cytokines associated with muscle invasive bladder cancer; the roles of IL-5, IL-20, and IL-28A. PLoS One. 2012; 7 (9): e40267. doi: 10.1371/journal.pone.0040267
35. Li L., Fu F., Xue M., Chen W., Liu J., Shi H., Chen J., Bu Z., Feng L., Liu P. IFN-lambda preferably inhibits PEDV infection of porcine intestinal epithelial cells compared with IFN-alpha. Antiviral Res. 2017; 140: 76–82. doi: 10.1016/j.antiviral.2017.01.012
36. Li Z., Lu X., Zhu Y., Cheng P., Liu S., Zhang Y., Tang J., Yang S., Zhou L. Lambda-interferons inhibit herpes simplex virus type 2 replication in human cervical epithelial cells by activating the JAK/STAT pathway. Jpn. J. Infec. Dis. 2017; 70 (4): 416–422. doi:10.7883/yoken.JJID.2016.465
37. Luo Q., Liu Y., Liu S., Yin Y., Xu B., Cao J. Interleukin 28 is a potential therapeutic target for sepsis. Clin. Immunol. 2019; 205: 29–34. doi: 10.1016/j.clim.2019.05.012
38. Mordstein M., Kochs G., Dumoutier L., Renauld J.C., Paludan S.R., Klucher K., Staeheli P. Interferon-lambda contributes to innate immunity of mice against influenza A virus but not against hepatotropic viruses. PLoS Pathog. 2008; 4. e1000151. doi: 10.1371/journal.ppat.1000151
39. Mordstein M., Neugebauer E., Ditt V., Jessen B., Rieger T., Falcone V., Sorgeloos F., Ehl S., Mayer D., Kochs G. Lambda interferon renders epithelial cells of the respiratory and gastrointestinal tracts resistant to viral infections. J. Virol. 2010; 84: 5670–5677. doi:10.1128/JVI.00272-10
40. Mucha J., Majchrzak K., Taciak B., Hellmén E., Król M. MDSCs mediate angiogenesis and predispose canine mammary tumor cells for metastasis via IL-28/ IL-28RA (IFN-λ) signaling. PLoS ONE. 2014; 9 (7): e103249. doi: 10.1371/journal.pone.0103249
41. Muir A.J., Arora S., Everson G., Flisiak R., George J., Ghalib R., Gordon S.C., Gray T., Greenbloom S., Hassanein T., Hillson J., Horga M.A., Jacobson I.M., Jeffers L., Kowdley K.V., Lawitz E., Lueth S., Rodriguez-Torres M., Rustgi V., Shemanski L., Shiffman M.L., Srinivasan S., Vargas H.E., Vierling J.M., Xu D., Lopez-Talavera J.C., Zeuzem S. EMERGE study group. A randomized phase 2b study of peginterferon lambda-1a for the treatment of chronic HCV infection. J. Hepatol. 2014; 61 (6). 1238–1246. doi: 10.1016/j.jhep.2014.07.022
42. Nelson M., Rubio R., Lazzarin A., Romanova S., Luetkemeyer A., Conway B., Molina J.M., Xu D., Srinivasan S., Portsmouth S. Safety and efficacy of pegylated interferon lambda, ribavirin, and daclatasvir in HCV and HIV-coinfected patients. J. Interferon Cytokine Res. 2017; 37 (3): 103–111. doi:10.1089/jir.2016.0082
43. Nice T.J., Baldridge M.T., McCune B.T., Norman J.M., Lazear H.M., Artyomov M., Diamond M.S., Virgin H.W. Interferon-λ cures persistent murine norovirus infection in the absence of adaptive immunity. Science. 2015; 347: 269–273. doi: 10.1126/science.1258100
44. O’Brien T.R., Young H.A., Donnelly R.P., Prokunina-Olsson L. Meeting overview: interferon lambda-disease impact and therapeutic potential. J. Interferon Cytokine Res. 2019. 39 (10): 586–591. doi:10.1089/jir.2019.0018
45. Oke V., Brauner S., Larsson A., Gustafsson J., Zickert A., Gunnarsson I., Svenungsson E. IFN-λ1 with Th17 axis cytokines and IFN-α define different subsets in systemic lupus erythematosus (SLE). Arthritis Res. Ther. 2017; 19 (1): 139–151. doi: 10.1186/s13075-0171344-7
46. Phillips S., Mistry S., Riva A., Cooksley H., Hadzhiolova-Lebeau T., Plavova S., Katzarov K., Simonova M., Zeuzem S., Woffendin C., Chen P.J., Peng C.Y., Chang T.T., Lueth S., de Knegt R., Choi M.S., Wedemeyer H., Dao M., Kim C.W., Chu H.C., Wind-Rotolo M., Williams R., Cooney E., Chokshi S. Peg-interferon lambda treatment induces robust innate and adaptive immunity in chronic hepatitis b patients. Front. Immunol. 2017; 8: 621. doi: 10.3389/fimmu.2017.00621
47. Planet P.J., Parker D., Cohen T.S., Smith H., Leon J.D., Ryan C., Hammer T.J., Fierer N., Chen E.I., Prince A.S. Lambda interferon restructures the nasal microbiome and increases susceptibility to Staphylococcus aureus superinfection. MBio. 2016; 7 (1): e01939-15. doi: 10.1128/mBio.01939-15
48. Pott J., Mahlakoiv T., Mordstein M., Duerr C.U., Michiels T., Stockinger S., Staeheli P., Hornef M.W. IFN-lambda determines the intestinal epithelial antiviral host defense. Proc. Natl. Acad. Sci. USA. 2011; 108 (19): 7944–7949. doi: 10.1073/pnas.1100552108
49. Rich H.E., McCourt C.C., Zheng W.Q., McHugh K.J., Robinson K.M., Wang J., Alcorn J.F. Interferon lambda inhibits bacterial uptake during influenza superinfection. Infect. Immun. 2019. 87 (5): e00114–19. doi: 10.1128/IAI.00114-19
50. Rivera A. Interferon lambda’s new role as regulator of neutrophil function. J. Interferon Cytokine Res. 2019. 39 (10): 609–617. doi: 10.1089/jir.2019.0036
51. Rocha-Pereira J., Jacobs S., Noppen S., Verbeken E., Michiels T., Neyts J. Interferon lambda (IFN-λ) efficiently blocks norovirus transmission in a mouse model. Antiviral Res. 2018; 149: 7–15. doi:10.1016/j.antiviral.2017
52. Sauerhering L., Müller H., Behner L., Elvert M., Fehling S.K., Strecker T., Maisner A. Variability of interferon-λ induction and antiviral activity in Nipah virus infected differentiated human bronchial epithelial cells of two human donors. J. Gen. Virol. 2017; 98 (10): 2447–2453. doi: 10.1099/jgv.0.000934
53. Sheppard P.O., Fox B.A., Klucher K.M., Taft D.W., Kindsvogel W.R. Cytokine protein family. Patent WO2002086087 US; Publ. 31.10.2002.
54. Sheppard P., Kindsvogel W., Xu W., Henderson K., Schlutsmeyer S., Whitmore T.E., Kuestner R., Garrigues U., Birks C., Roraback J., Ostrander C., Dong D., Shin J., Presnell S., Fox B., Haldeman B., Cooper E., Taft D., Gilbert T., Grant F.J., Tackett M., Krivan W., Mcknight G., Clegg C., Foster D., Klucher K.M. IL-28, IL-29 and their class II cytokine receptor IL-28R. Nat. Immunol. 2003; 4: 63–68. doi: 10.1038/ni873
55. Swamy M., Abeler-Dörner L., Chettle J., Mahlakõiv T., Goubau D., Chakravarty P., Ramsay G., Reis E., Sousa C., Staeheli P., Blacklaws B.A., Heeney J.L., Hayday A.C. Intestinal intraepithelial lymphocyte activation promotes innate antiviral resistance. Nat. Commun. 2015; 6: 7090. doi: 10.1038/ncomms8090
57. Wang X., Wang H., Liu M.Q., Li J.L., Zhou R.H., Zhou Y., Wang Y.Z., Zhou W., Ho W.Z. IFN-λ inhibits drug-resistant HIV infection of macrophages. Front. Immunol. 2017; 8: 210. doi: 10.3389/fimmu.2017.00210
58. Wieland S.F., Heim M.H. The IFN-λ pony express. Nat. Immunol. 2019; 20 (5): 522–524. doi:10.1038/s41590-019-0362-9
59. Wolk K., Witte K., Witte E., Raftery M., Kokolakis G., Philipp S., Schonrich G., Warszawska K., Kirsch S., Prosch S., Sterry W., Volk H.D., Sabat R. IL-29 is produced by T(H)17 cells and mediates the cutaneous antiviral competence in psoriasis. Sci. Transl. Med. 2013; 5 (204): 204–129. doi: 10.1126/scitranslmed.3006245
60. Won J., Gil C.H., Jo A., Kim H.J. Inhaled delivery of Interferon-lambda restricts epithelial-derived Th2 inflammation in allergic asthma. Cytokine. 2019; 119: 32–36. doi: 10.1016/j.cyto.2019.02.010
63. Ye L., Schnepf D., Becker J., Ebert K., Tanriver Y., Bernasconi V., Gad H.H., Hartmann R., Lycke N., Staeheli P. Interferon-λ enhances adaptive mucosal immunity by boosting release of thymic stromal lymphopoietin. Nat. Immunol. 2019; 20 (5): 593–601. doi: 10.1038/s41590-019-0345-x
64. Yu D., Zhao M., Dong L., Zhao L., Zou M., Sun H., Zhang M., Liu H., Zou Z. Design and evaluation of novel interferon lambda analogs with enhanced antiviral activity and improved drug attributes . Drug. Des. Devel. Ther. 2016; 10: 163–182. doi: 10.2147/DDDT.S91455

— Первая и основная клетка, в которую проникает вирус — эпителиальная. Прежде всего, речь идет об эпителиальных клетках верхних дыхательных путей. Ведь основные ворота для проникновения вируса — это носоглотка и ротоглотка. При дальнейшем успешном развитии инфекции поражаются средние и нижние дыхательные системы.
В части случаев вирус поражает и другие органы и системы человека — желудочно-кишечный тракт и почки. Об этом свидетельствует соответствующая симптоматика — диарейный синдром и почечная недостаточность.
Когда в январе 2020 году инфекция стала известна широкому кругу специалистов, считалось, что единственный путь попадания вируса в клетку осуществляется с помощью ангиотензинпревращающего фермента — рецептора, получившего название ACE2. Но оказалось, что существует второй рецептор, который выполняет функцию входных ворот для вируса в клетку — CD147. Чем он примечателен?
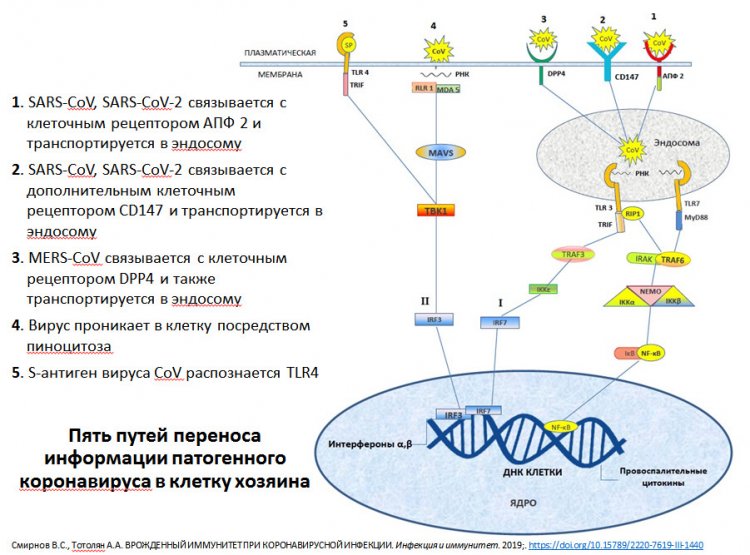
Схема путей переноса информации патогенного коронавируса в клетку хозяина. Из презентации А.А. Тотоляна
Этот белок располагается на поверхности или мембране клетки. Против него уже существует моноклональное антитело — то есть лекарственный препарат, который применяют при лечении некоторых онкологических заболеваний. Поэтому в ряде зарубежных странах были инициированы клинические исследования этого препарата как возможного кандидата для лечения COVID-19. Исследования продолжаются, но пока результатов нет. Если этот препарат окажется эффективным, то это значительно упростит ситуацию, а главное — сэкономит время.
Вернемся к вопросу. Вирус, проникая в клетку, запускает целый ряд механизмов, которые приводят к развитию дефектов. Нормальная клетка при проникновении чужеродного микроорганизма ведет себя соответствующим образом. Одно из проявлений ее поведения связано с выработкой интерферона.
— Что собой представляет интерферон и каково его место в иммунной системе?
— Интерфероны — это семейство белковых молекул, которые продуцируются различными клетками организма человека и обеспечивают, в том числе, противовирусный иммунитет. При этом интерфероны обладают неспецифической активностью, то есть действуют не на возбудителя какого-то конкретного заболевания, а на любые вирусные частицы в целом. На сегодняшний день известно целое семейство интерферонов — 20 разных молекул, объединенных одним названием.
Поэтому, в первую очередь, нас интересует интерферон альфа. По идее эпителиальные клетки должны были вырабатывать интерферон альфа и гамма при встрече с коронавирусом. Но в отношении интерферона альфа этого не происходит. Почему? Дело в том, что у вируса SARS-CoV-2 есть определенные механизмы, с помощью которых он подавляет не только продукцию интерферона, но и сам синтез.
— Как ему это удается?
— Эти процессы происходят на молекулярном уровне. Они приводят к дефекту эпителиальной клетки, после чего она не может продуцировать интерферон альфа. Этот факт имеет множество последствий для организма. Чтобы не допустить этого, специалисты проводят заместительную терапию с помощью препаратов на основе интерферона альфа, которые позволяют восполнить дефицит.
— Так мы помогаем иммунитету?
— Да, верно. Мы вводим интерферон извне, тем самым компенсируя дефект, вызванный вирусом. Препараты на основе интерферона альфа особенно должны быть эффективны на ранних этапах, пока инфекция не спустилась в нижние отделы дыхательных путей.
А интерферон гамма, напротив, важен на поздних этапах, когда инфекция сопровождается пневмонией и так называемым цитокиновым штормом.
Если цитокинового шторма нет, применять препараты для антицитокиновой терапии нельзя. Ведь так мы добьемся диаметрально противоположного результата. Выключение любого нормально функционирующего компонента иммунной системы приводит к развитию иммуносупрессии — дефекта иммунной системы.
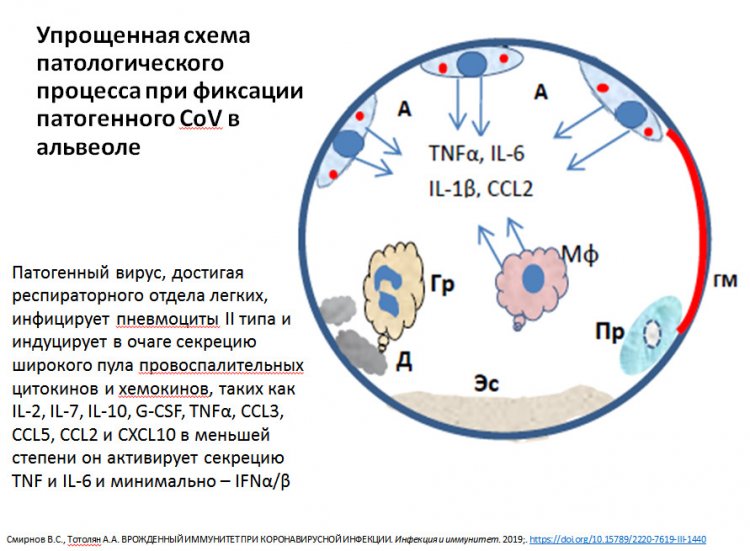
Схема патологического процесса при фиксации вируса в альвеоле. Из презентации А.А. Тотоляна
— Давайте поговорим об особенностях протекания болезни COVID-19. Почему она поражает именно легкие? Вирусу комфортнее в этой среде или есть какие-то другие объяснения?
— Просто вирусу проще попасть в организм через нос или рот, а затем в легкие. А в ряде случаев, как я уже упоминал, он попадает в желудочно-кишечный тракт.
— Сейчас многие научные коллективы ищут вакцину и лекарство против нового коронавируса. На чем они будут основаны?
— Начнем с вакцин. Сегодня как минимум 8 коллективов в России занимаются разработкой вакцины. Если ее удастся создать, то она поможет нам со второй волной пандемии. По разным оценкам, вирус может приобрести сезонный характер.
Я не думаю, что мы успеем использовать вакцину в нынешней ситуации. Скорее всего, пандемия завершится до того, как вакцина получит путевку в жизнь. Это работа, прежде всего, на перспективу. По сути, вакцина — это долгосрочная профилактика. Ее появление позволит нам быстро сформировать иммунизированную прослойку, которая будет защищать остальных.
Ведь мы не можем иммунизировать всех подряд. Существуют определенные ограничения, которые не позволяют использовать одну и ту же вакцину для всех. Есть также пациенты с иммунодефицитом, приобретенным или врожденным. Для таких групп пациентов некоторые вакцины просто противопоказаны. Именно поэтому 100%-я вакцинация не достигается. Но она, по существу, и не нужна. Согласно теории коллективного иммунитета, достаточно 70% населения с иммунитетом к вирусу, чтобы избежать пандемии.
Если говорить о лечении, то наиболее эффективными специфичными против вируса иммунопрепаратами должны стать терапевтические моноклональные антитела — антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону, то есть произошедшими из одной плазматической клетки-предшественницы. Пока таких препаратов в нашем распоряжении нет, клиницисты идут другим путем: переливают плазму реконвалесцентов, то есть выздоравливающих людей. В крови выздоровевших имеются специфические антитела. Их плазму крови вводят тем, кто наиболее тяжело переносит заболевание.
— Какие препараты, разрабатываемые сегодня, будут наиболее перспективными?
— На первое место я бы поставил терапевтические антитела. Моноклональные антитела, как я уже говорил, это препараты, которые обладают высокой селективностью в отношении молекулярной мишени. Антитела обладают способностью точно связываться с антигеном благодаря специальным антигенсвязывающим участкам, имеющим к нему высокую специфичность. Это определяет селективность лекарств на основе антител в отношении конкретной мишени.
Вторые по значимости — пептиды, которые могут обладать активностью против вируса. В своих исследованиях мы решили пойти как раз по этому пути. Как нам кажется, результаты могут оказаться весьма перспективными.
Интервью осуществлено при поддержке Министерства науки и высшего образования РФ и Российской академии наук

—Верно ли полагать, что действенное лекарство не только будет бороться с симптомами и осложнениями при инфицировании коронавирусом, но и подавлять сам вирус в организме?
— Действие лекарственных средств принято делить на этиотропное, патогенетическое и симптоматическое. Лекарства с этиотропным действием влияют на причину болезни, необязательно вирусную, это относится к любому заболеванию. Патогенетическое действие осуществляют лекарства, которые влияют на механизм развития болезни, а симптоматическое – только на проявления заболевания, например, повышение температуры и т.п. Механизмы развития заболевания могут быть различными, но самым оптимальным считается все-таки то лекарство, которое действует на первопричину болезни. Поэтому я считаю, что эффективными будут лекарства, которые действуют на сам вирус.
Кроме того, существуют более популярные примеры, которые на слуху. К ним относятся попытки использовать для борьбы с COVID-19 противомалярийные препараты, препараты для лечения ВИЧ-инфекции и другие. Безусловно, все это рационально и, что немаловажно, быстрее. Такие примеры сейчас дают надежду на успешную борьбу с новым вирусом.
—Сегодня многие препараты регистрируют по ускоренной процедуре. Есть ли в этом определенная опасность и риски?
—Безусловно, существует, если не риск, то конкретная необходимость в проведении дальнейших исследований, уже в ходе использования препарата. В целом, такие исследования обязательны и проводятся в отношении любого лекарства. После регистрации медицинские работники, которые применяют препарат, обязаны регистрировать возникающие побочные эффекты, которых, например, нет в инструкции к применению. И в ситуации с коронавирусной инфекцией к такой работе необходимо подходить более ответственно и проводить ее в большем объеме.
— Согласны ли вы с тем, что в противостоянии коронавирусу человечеству все-таки остается надеяться на собственный иммунитет и карантинные меры, а также на успехи в разработке вакцины?
—Каково значение антибиотиков в борьбе с симптомами COVID-19, и может ли их массовое использование во время пандемии обернуться ускорением резистентности бактерий к антибиотикам?
—Самое тяжелое осложнение при инфицировании коронавирусом – это пневмония. И, как любая вирусная пневмония в процессе развития и в своем исходе, она характеризуется присоединением бактериальной инфекции, для борьбы с которой в каждом случае, конечно, необходимо назначать антибиотики. Однако в этой ситуации врачи вынуждены выбирать меньшее из двух зол. Безусловно, существует опасность развития устойчивости вторичной флоры к антибиотикам, а также излишняя антибиотическая нагрузка на организм ни к чему хорошему не приводит. Но, в первую очередь, специалисты руководствуются необходимостью спасения пациента. А дальше, к сожалению, уже приходится бороться с последствиями лечения.
—Расскажите о лекарственном препарате на основе интерферона-лямбда и его потенциальном противовирусном действии против COVID-19?

Из презентации В.В. Жданова

Из презентации В.В. Жданова
—А в чем преимущество этого препарата?
— Очевидно преимущество, по сравнению с синтетическими средствами, которые сейчас используют, либо разрабатывают для использования при коронавирусе. Интерферон-лямбда – это компонент неспецифического иммунитета, и действие его не зависит от разновидностей вируса, от штамма. Например, есть опасение, что одни противовирусные препараты будут действовать против одного штамма коронавируса, но против другого не будут. Также вакцины, которые создаются против существующей сейчас разновидности коронавируса, при его малейшей мутации, (а эти изменения постоянно происходят), могут стать неэффективными. А в случае с интерфероном-лямбда мы имеем дело с белком, который вырабатывает организм для борьбы с широким спектром вирусов. И поэтому можно надеяться на его эффективность, которая не будет зависеть от вида вируса. Я думаю, что именно в этом одно из самых больших преимуществ.
И, кроме того, поскольку это вещество изначально вырабатывает сам организм, для организма оно достаточно физиологично. Мы же просто наращиваем количество этого противовирусного белка за счет того, что вводим созданный искусственно белок извне.
— Как повлиял коронавирус на фармакологическую индустрию?
— Наверное, пока рано говорить, поскольку пандемия еще не побеждена. Результат мы увидим позже. Но то, что можно уже сейчас наблюдать в новостях о фармкомпаниях, говорит о перепрофилировании производства крупных фармпроизводителей в сторону противовирусных средств, во-первых. Но и самое главное – свидетельствует об очень быстром развитии фармацевтических компаний, которые работают с биотехнологиями, поскольку именно таким путем создаются современные вакцины и препараты на основе антител, рекомбинантных белков для борьбы с коронавирусом. Например, тот же интерферон-лямбда, о котором мы говорили, это рекомбинантный белок. Определенно, ситуация с коронавирусом придаст импульс для развития такого высокотехнологического направления как биотехнологическая фармацевтика.
—Какой урок следует извлечь из всей ситуации с коронавирусом?
—Сложно сказать, какой урок. Скорее всего то, что возможно повторение подобной эпидемии. Когда пандемия закончится, (и закончится ли вообще – неизвестно), главное – это быть осторожными, быть готовыми к развитию эпидемических ситуаций в будущем, соблюдать меры профилактики, укреплять здоровье и иммунитет.
Интервью проведено при поддержке Министерства науки и высшего образования и Российской академии наук.

АМИКСИН ® — оригинальный современный противовирусный препарат, усиливает выработку всех типов интерферонов и антител при ОРВИ.
Узнать подробнее про АМИКСИН ® …
Имеются противопоказания. Необходимо получить консультацию специалиста.

Противовирусные препараты можно применять не только для лечения ОРВИ, но и для профилактики. Узнайте, что способствует снижению риска заражения до 3–4 раз!

Препарат АМИКСИН ® активен на любом этапе ОРВИ: в начале болезни, на ее пике и при затяжном течении.
Как принимать препарат?
Имеются противопоказания. Необходимо получить консультацию специалиста.

В лечении ОРВИ большое значение имеет удобная схема приема. Узнайте, курс лечения каким противовирусным препаратом составляет всего 6 таблеток!

АМИКСИН ® обладает благоприятным профилем безопасности и хорошей переносимостью. Совместим с вакцинотерапией, антибиотиками и другими лекарственными средствами.
Подробнее о препарате…
Имеются противопоказания. Необходимо получить консультацию специалиста.

Лечение ОРВИ должно начинаться ВОВРЕМЯ. Амиксин ® — максимум активности уже в первые 24 часа!
Подробнее… Имеются противопоказания. Необходимо получить консультацию специалиста.
Функции и механизм действия интерферона в человеческом организме
Интерферон — это белковая молекула, которая обеспечивает противовирусный иммунитет. При этом она обладает неспецифической активностью, то есть действуют не на возбудителя какого-то конкретного заболевания, а на все вирусные частицы в целом. Если сказать обобщенно, то интерферон — универсальный защитник организма, который начинает действовать еще до того, как в работу включатся остальные звенья иммунитета [1] . Препараты интерферона применяются даже в терапии онкологии: они подавляют опухолевый рост.
Клетки вырабатывают этот защитный белок в ответ на действие вирусов, бактерий, опухолевых клеток или продуктов их метаболизма. Стимулировать их выработку могут и лекарственные препараты — индукторы интерферона. Молекулы последних, попадая в кровь и межклеточную жидкость, связываются с рецепторами зараженных или поврежденных клеток. Они запускают сложный каскад реакций, приводящих к образованию специфических белков. В результате клетка перестает воспроизводить вирусные частицы, расщепляет их генетическую структуру, а поверхность этой клетки становится менее проницаемой для внутриклеточных паразитов.
Кроме действия на сами зараженные клетки, интерфероны стимулируют активность других звеньев иммунитета, контролируют воспалительную реакцию [2] и даже могут защитить организм от опухолей. Это свойство активно изучают и уже используют для борьбы с некоторыми видами рака [3] .
Виды человеческого интерферона
Молекулы интерферона отличаются между собой по генетической структуре, типу клеточных рецепторов, на которые они действуют, даже по участкам ДНК, которые кодируют их состав. Все интерфероны делят на 3 типа.
- К первому типу относят альфа-интерферон, который имеет 13 различных структурных вариантов, а также бета-, каппа-, эпсилон- и омега-.
- Второй тип представлен только одним типом, гамма-интерфероном.
- Относительно недавно, в 2002 году, был открыт и третий тип молекул, лямбда-. Это отдельное семейство интерферонов, которое отличается от всех предыдущих генетическим строением и даже типом рецепторов, с которыми они взаимодействуют. Но по своей биологической активности лямбда-интерфероны очень похожи на первый тип [4] .
Не стоит относиться к интерферонам как к панацее от всех бед. Во-первых, некоторые вирусы могут подавлять образование специфических белков внутри зараженных клеток, что значительно снижает эффективность противовирусной защиты.
Поэтому прежде чем начинать лечение препаратами интерферона, нужно внимательно изучить пользу и возможный вред от их приема.
Применение аналогов интерферона в медицине
Лекарственные средства на основе интерферона доказали свою эффективность [5] в лечении широкого круга заболеваний: герпетических инфекций, ВПЧ, острых и хронических форм вирусного гепатита, рассеянного склероза, волчанки, гриппа и многих других вирусных и бактериальных инфекций. Применяют интерферон и при терапии онкологических заболеваний, а также СПИДа. И это притом, что по меркам медицины открыли его совсем недавно. Это произошло в 1957 году при проведении опытов на мышах. Ученые обратили внимание, что животные, заразившиеся одним вирусом, становились невосприимчивы к другому вирусному заболеванию. Это явление было названо интерференцией, а вещества, которые ему способствовали — интерферонами. Оказалось, что интерфероны вырабатываются не только у мышей, но и у всех млекопитающих, в том числе у человека. Началось изучение возможности промышленного производства веществ, обладающих противовирусным эффектом.
Однако долгое время применение интерферонов было ограничено из-за несовершенства процедуры их получения. Выделять это вещество из крови человека-донора было сложно, дорого и неэффективно.
Цифры и факты
В 1 литре крови донора содержится всего 1 мкг интерферонов. Примерно такое количество этих молекул нужно для того чтобы изготовить всего одну дозу препарата [6] . А за курс лечения тяжелых вирусных заболеваний, таких как гепатит, человек может получить около 150 доз [7] .
В 1980 году в Японии впервые использовали для производства интерферона специально выращенную культуру лимфобластных клеток. А в 1981 году в США вместо клеток человека использовали культуру дрожжевых грибков. С помощью генной инженерии в геном ввели ген, который кодирует производство молекулы интерферона. Это позволило значительно упростить производство препарата [8] .
По способу производства существует четыре основных разновидности этого препарата: лейкоцитарный, лимфобластоидный, рекомбинантный и пегилированный.
После получения такой препарат очищают и концентрируют. В него могут входить все виды интерферонов и другие биологически активные вещества. Это одновременно и плюс, и минус. Преимущество такого препарата — его высокий потенциал биологического действия. Недостаток — высокая вероятность побочных эффектов при внутримышечном введении.
Лимфобластоидный интерферон получают не от человека-донора, а из культуры лимфобластных клеток, которые также обрабатывают веществами, стимулирующими иммунный ответ. Такие препараты содержат определенное соотношение различных видов интерферона и не так часто вызывают побочные эффекты.
Пегилированные, или ПЭГ-интерфероны — это рекомбинантные белковые молекулы, соединенные с полиэтиленгликолем. Такое соединение увеличило срок действия интерферона в организме.
К примеру
Если стандартный рекомбинантный интерферон при лечении вирусного гепатита C нужно вводить три раза в неделю, то пегилированный достаточно использовать один раз за то же время [10] .
ПЭГ растворим в воде, не вступает в биологические реакции в организме и не вызывает иммунного ответа. При присоединении ПЭГ молекула интерферона значительно увеличивается в размерах. А это, в свою очередь, увеличивает период полувыведения препарата.
Препараты на основе интерферона: показания и противопоказания к их применению
Объединить интерфероны в однородные группы по методу получения, формам выпуска и показаниям не получится. Каждый препарат имеет свои особенности применения, эффективность при определенных заболеваниях. В зависимости от степени очистки и других факторов какие-то препараты с одним и тем же видом иммуноглобулина могут применяться только местно, а какие-то можно использовать в виде инъекций.
Поэтому при выборе препарата интерферона стоит ориентироваться не только на общую характеристику группы веществ, но в первую очередь на рекомендации врача и инструкцию по применению конкретного препарата.
Интерферон в виде инъекций применяют при системных заболеваниях, таких как гепатит, опухоли или рассеянный склероз. Препарат в виде капель в нос подходит для лечения риносинуситов и профилактики ОРВИ. Капли в глаза помогут при конъюнктивите. Суппозитории можно использовать при многих заболеваниях, в том числе у детей. А гель подходит для смазывания носа или кожи.
Интерфероны защищают организм от вирусов, бактерий и опухолевых клеток. Они обладают сложным биологическим действием. Но современная медицина научилась создавать аналогичные вещества и использовать их. Однако подбор подходящего препарата — задача, которую может решить только врач.
Что такое индукторы интерферона
Преимущества этого препарата — максимум выработки интерферона уже в первые сутки от начала приема и активация четырех видов интерферонов. Увеличение концентрации интерферонов в отдельных органах может достигаться уже через 4 часа.
Все индукторы интерферона обладают индивидуальными характеристиками, показаниями и противопоказаниями. Поэтому препарат нужно выбирать внимательно, только после прочтения инструкции. С особой осторожностью нужно подходить к выбору лекарства, если его нужно принимать детям. Для детей существуют отдельные формы выпуска.
И, конечно, никогда нельзя заниматься самолечением. Любые препараты нужно принимать только по согласованию с врачом.
Лямбда-интерферон предназначается нетяжелым больным
Исследователи из Медицинской школы Стэнфордского университета ведут клинические испытания лямбда-интерферона для лечения больных ковидом. По их предположению, лямбда-интерферон должен помочь выздороветь нетяжелым больным, а следовательно, прервать цепочки распространения нового коронавируса.

Фото: Александр Миридонов, Коммерсантъ / купить фото
Фото: Александр Миридонов, Коммерсантъ / купить фото
Идея состоит в том, чтобы пациентов, которые дали положительный ответ в тесте на ковид, но неплохо себя чувствуют — а таких большинство,— отправлять домой с запасом лямбда-интерферона. Они быстрее выздоровят и перестанут быть источником опасности для незараженных людей.
Лямбда-интерферон — синтетический препарат, соответствующий природному белку в организме человека. Он считается весьма перспективным средством для лечения вирусных гепатитов. Лямбда-интерфероны открыты в 2003 году, они действуют по схожему с альфа-интерферонами механизму, но имеют иную тканевую специфичность. В частности, они защищают легочную ткань, которая при ковиде становится одним из наиболее уязвимых мест, а также другую мишень коронавируса — клетки желудочно-кишечного тракта. Альфа-интерфероны стали одним из рутинных средств борьбы с гепатитом С и радикально изменили положение дел в мире с этой социально опасной инфекцией.
В программе испытаний противогепатитных свойств лямбда-интерферонов уже поучаствовали около 3 тыс. человек. Руководитель исследовательской группы Прасанна Джаганнатан считает, что препарат показал себя как исключительно безопасный.
Тесты на животных показывают, что лямбда-интерфероны перспективны при борьбе с разными видами вирусов — помимо гепатитов это еще и грипп, и другие острые респираторные заболевания вирусной природы. Есть основания предполагать, что лямбда-интерфероны будут активны и против нереспираторных вирусов.
Пока что только ремдесивир, недавно одобренный к применению американским Управлением по контролю за качеством пищевых продуктов и медикаментов, можно использовать конкретно против ковида. Но ремдесивир — средство госпитальной терапии, то есть для тяжелых случаев, а 80% ковидных больных — амбулаторные.
Сейчас стэнфордские исследователи набирают 120 добровольцев с недавно диагностированным ковидом (в нетяжелой форме). Их разделят на две группы: половина получит инъекцию плацебо, другая — инъекцию лямбда-интерферонов. Затем ученые будут 28 дней контролировать их реакцию, а также следить за выделением вируса.
Читайте также:

